E-Drugs (Electronic Drugs): Spatial and Temporal Medical Treatment of Human Disease
<Introduction>

몸이 아프거나 증상이 있을 때, 기존에는 약을 먹거나, 주사를 맞거나, 직접 그 부위를 수술하는 등의 치료 방법들이 시행되어 왔습니다. 하지만 위의 방법들은 환자들이 치료사의 조언을 잘 따르지 않아 통증이 만성화 되거나, 약효가 나타나기 시작하는 약물의 혈중 농도와 부작용이 나타나기 시작하는 약물의 혈중농도 차이가 작아 치료가 어렵거나, 수술 한 부분의 조직이 손상되고 감염되는 위험이 있을 수 있습니다. 따라서 오늘 제가 발표하려는 주제는, 기존의 치료 방법들의 한계점에 대한 혁신적인 해답을 가져다 줄 수 있는 E-Drug에 대해 소개해드리고자 합니다
<E-Drug>

E-drug란 실시간으로 생체내의 신호를 검출하고, 지정된 조직이나 장기에 특정한 약물을 배달하는 등 우리 몸의 치료를 돕기 위한 Electronic Device입니다. 이는 불필요한 수술을 최소화할 수 있으며, 환자의 건강 상태를 보다 더 빠르고, 정확하게 검출할 수 있다는 장점들이 있습니다
> Non-Invasive Therapy

먼저 GI-Tract와 관련된 치료 및 검출을 위한 Ingestible E-Drug에 대해 말씀드리겠습니다. GI tract, 즉 소화관은 크게 구강, 위장, 맹장의 상부 소화계와 소장, 대장의 하부 소화계로 이루어져 있으며, 신진대사와 함께 영양소의 흡수를 위한 소화 등 우리 몸에 중요한 역할을 담당하고 있습니다. 하지만, 소화관을 구성하는 장기들은 각기 다른 기능과 조직 환경으로 구성되어 있어 각각의 병리를 밝히는 과정 및 치료 또한 모두 다르게 됩니다

또한, 소화관 내에서의 Microbiome은 식단에 따라서도 쉽게 그 환경이 바뀌게 되는데, 소화관 내에서의 불균형한 Micro-environment는 당뇨병이나 소화 장애 등의 위험을 높일 수 있으므로 소환관 환경의 지속적인 관찰에 대한 중요성이 증가하고 있습니다. 이에, Gibson 연구팀은 소화기관 내에서의 가스의 정도를 측정할 수 있는 가스 센서를 개발하였습니다. 센서와 Sensor Permeable Membrane으로 구성된 이 가스 센서는 전기적 신호를 통해 발효된 가스의 양을 측정하여 과민성 대장 증후군, 흡수 불량 등의 문제를 진단하는데 도움이 될 수 있었습니다

다음으로. Moshkowitz 연구팀은, 적은 양의 X-ray를 이용해 결장 내의 종양 및 결함 등을 3D 이미지로 보여줄 수 잇는 Ingestible e-drug를 개발하였습니다. 기존의 대장 내시경은 관장약을 4L이상 마셔야 하는 힘든 과정이 포함되어 있습니다. 이 과정에서 토를 하거나, 검사가 끝난 후에도 설사가 지속되는 등 몸에 적지 않은 무리가 가게됩니다. 이에 Moshkowitz 연구팀은 360도 회전하는 세 개의 X-ray beam이 대장 표면에 부딪히면서 생성되는 Compton 후방산란 광자와 X선 형광에 의한 광자를 Detection하여 3D 이미지를 만들 수 있는 캡슐을 소개하였습니다

여기서 Compton 산란이란 X선 광자가 전자와 충돌하여 에너지의 일부를 전자에 주고, 진동수가 낮은 광자가 되어 처음 입사 방향과 다른 방향으로 산란되는 현상을 말합니다. 또한, x선 형광이란 엑스선에 의해 안쪽 전자가 방출되면 바깥쪽 전자가 안쪽 전자의 자리로 떨어지면서 두 전자 상태의 에너지 차이에 해당하는 엑스선이 방출되는 현상을 의미합니다

따라서, 캡슐이 내려가면서 얻어진 고해상도의 3D 입체 이미지들을 통해 직접적으로 결장 내의 염증 및 종양의 유무를 판단할 수 있었고, 기존의 방법보다 더욱더 편리하게 내시경 검사를 진행할 수 있었습니다

다음으로는 G. Traverso연구팀의 SOMA(Self-Orienting millimeter-scale applicator)입니다. 기존의 많은 약들은 소화관에 들어가면서 위장의 강한 산성에 의해 Degradation이 되어 Target이 되는 곳에 약효가 제대로 들지 않는 경우가 많았습니다. 이에 대해 G. Traverso연구팀은 거북이의 등껍질을 모방하여 한 방향으로만 정렬되는 캡슐을 통해 원하는 곳에 Drug를 Delivery 할 수 있는 Ingestible Form의 캡슐인 SOMA를 개발하였습니다
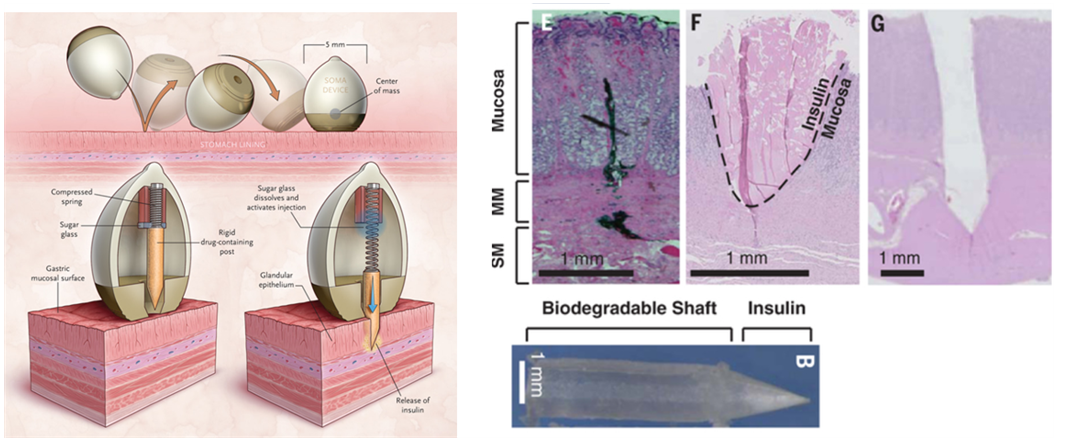
SOMA는 위장의 점막에 도착한 후, 스프링이 풀리면서 포스트 끝에 압축된 인슐린이 직접 점막 안의 조직으로 침투할 수 있게 되어, 약 효과를 더욱 극대화할 수 있었습니다
다음으로는 패치 타입의 E-drug에 대해 말씀드리겠습니다. 피부는 우리 몸의 대부분을 감싸고 있으며 조직액이나 땀과 같은 Biofluid를 분비합니다. 이때, Biofluid와 함께 피부의 PH값과 체온은 건강에 대한 많은 정보들을 포함하고 있습니다. 예를 들어, 상처가 난 곳에는 박테리아 달라붙어 바이오 필름이 형성되면서 PH가 증가하게 되며, 피가 몰리고 면역 반응으로 인해 그 지역의 체온이 증가하였습니다. 이러한 정보들을 이용하여, 연구자들은 Medical Device와 Fitness Application에 적용 가능한 패치타입의 e-drug에 관해 연구하기 시작했습니다
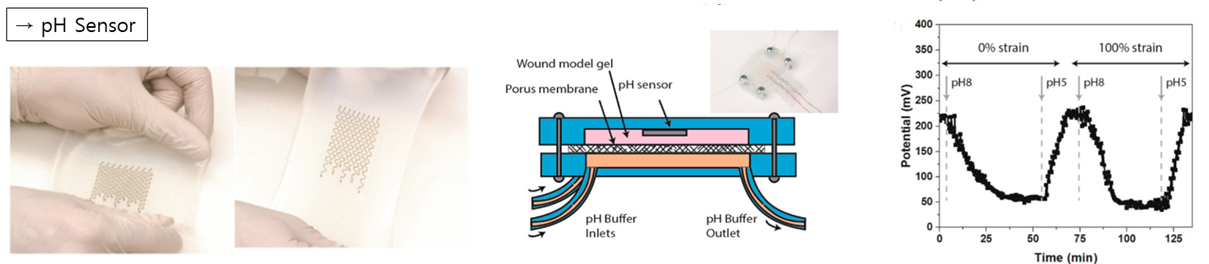
먼저, B. Ziaie 연구팀은 웨어러블이나 로보틱스 어플리케이션에 이용될 수 있는 Stretchable PH Sensor를 개발하였습니다. 오른쪽 그래프에서 볼 수 있듯이, 염기성을 주입했을 때는 포텐셜이 떨어지고, 산성을 주입했을 때는 포텐셜이 다시 증가하는 것을 확인할 수 있었습니다
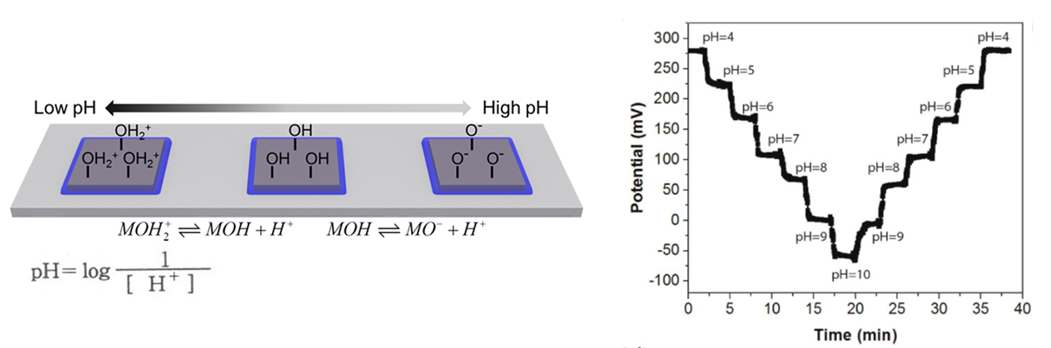
이는 PH 값에 따라 Layer 위의 OH에 수소 이온이 결합하거나 떨어지면서 나타나게 되는 결과입니다. 이때, 사람의 피부는 정상일 때 5.5정도의 약산성을 띄며, 상처가 나 염증반응이 일어났을 때는 8정도의 염기성을 띄게 되므로, 우리는 PH Sensor를 통해 Potential Value를 측정함으로써 피부의 상처가 어느 정도 회복되고 있는지에 대한 경과를 확인할 수 있습니다
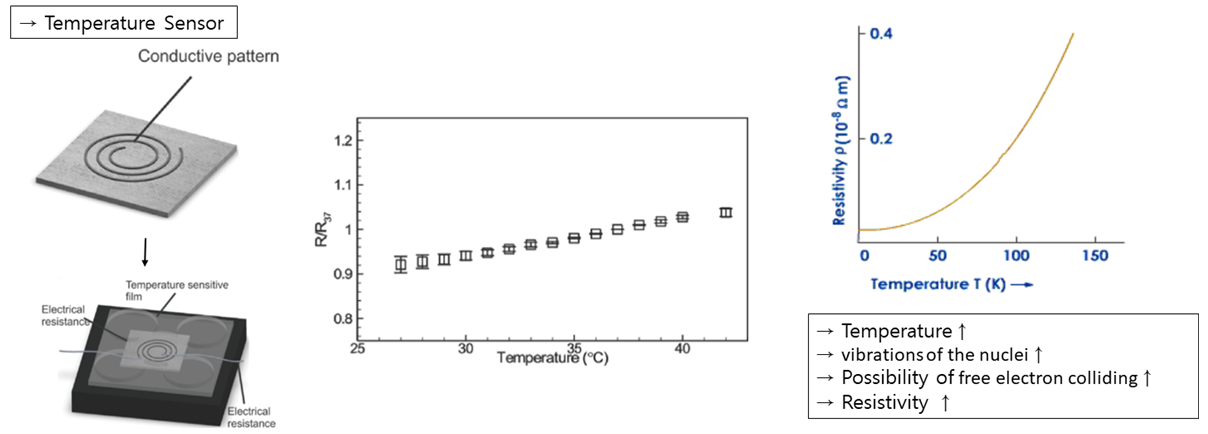
다음으로는 Temperature Sensor에 대해 말씀드리겠습니다. 감염에 의한 면역반응 과정으로 상처난 곳은 열이 발생하게 되는 됩니다. 이때 금속은 온도가 높아질수록 자유전자가 충돌할 확률이 높아져 저항성이 올라가게 되는데요. A. Khademhosseini 연구팀은 이를 응용하여 Stretchable하고 Biodegradable한 Substrate 위에 은 잉크를 이용한 Conductive Pattern에서의 온도에 따른 저항 값의 차이를 확인할 수 있는 센서를 만들 수 있었습니다
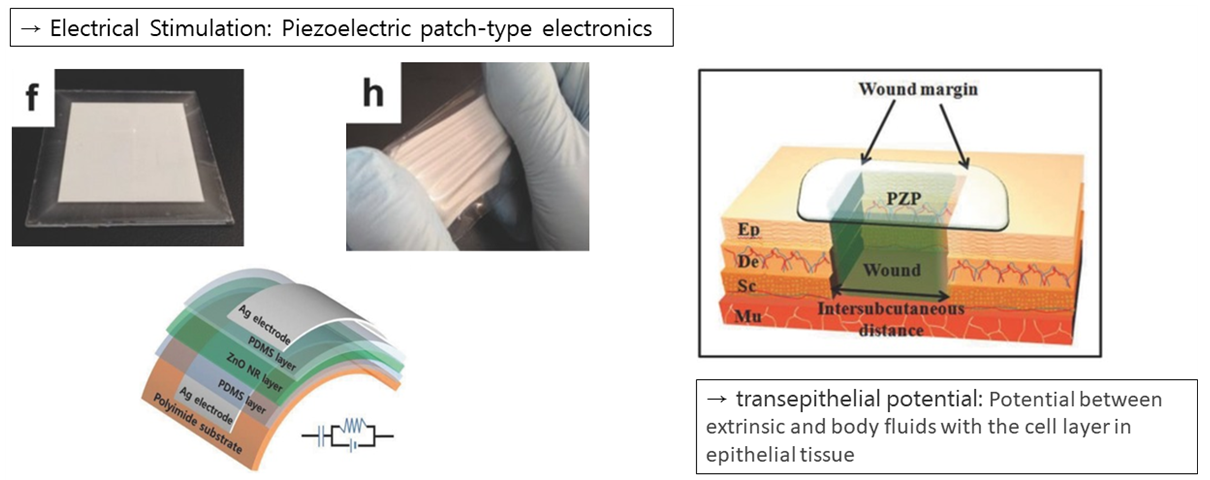
다음은 Piezo electric을 이용해 상처회복을 돕는 패치 타입의 Electronics에 대해 소개해드리겠습니다. 피부는 상처를 입게 되면 상피 전위에 의해서 생채 내의 전기장이 생성됩니다. 이때, 상피 전위란 상피조직에서 세포층을 사이에 두고 외액과 체액 사이에서 나타나는 전위를 의미합니다. 이렇게 생성된 전기장은 피부 세포의 행동을 Modulating하고 재생 효과를 촉진하여 피부 상처를 치료하는 데 도움을 줍니다. 김 연구팀은 이러한 원리를 응용하여 한 방향으로 정립된 Zinc oxide로 만들어진 Piezo patch에서 작은 Mechanical Deformation에 의해 만들어지는 Piezo 전위를 통해 치료 속도를 높일 수 있는 패치를 개발하였습니다
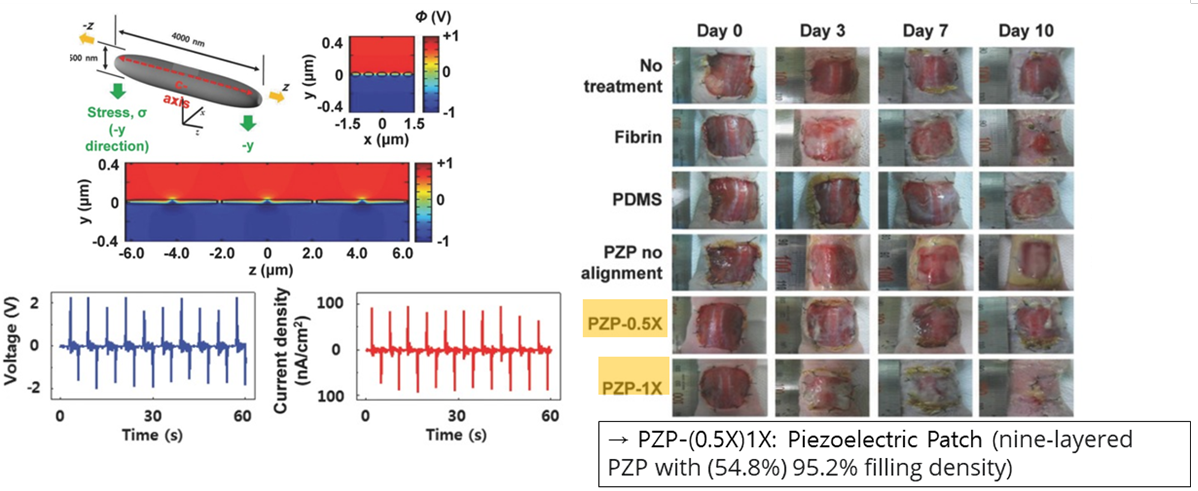
오른쪽 그림에서도 확인할 수 있듯 Piezo Electric Patch가 상처난 곳의 회복을 돕는 in vivo 실험결과를 확인할 수 있었습니다. 따라서, Piezo Electric Patch는 입원을 하여 기기를 통해 치료를 받는 번거로운 과정을 축소시키고, 치료에 대한 효과를 더욱 효율적으로 높일 수 있습니다
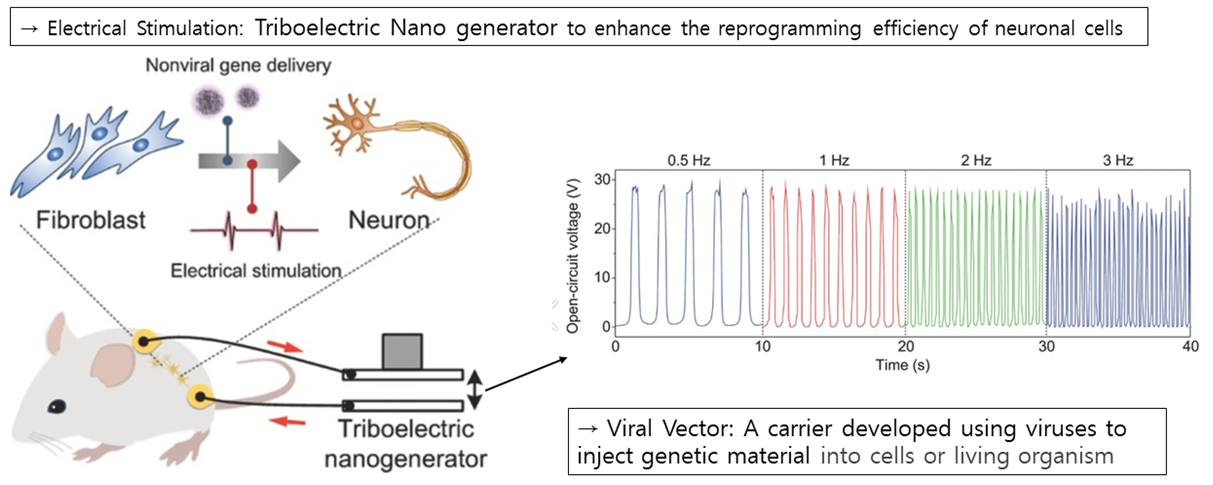
다음으로는 Triboelectric Nanogenerator의 펄스형태의 전기적 자극을 통해 Nonviral Conversion의 효율을 높여 Fibroblast가 Induced neuronal cell로 더욱 잘 바뀌게 되어 신경세포의 회복을 돕게 되는 연구에 대해 소개해드리겠습니다. 기존의 경우에는 Viral Vector를 이용해 신경손상 회복을 위한 유전자를 delivery하였는데, 이 경우 면역 유전자와 종양 유전자에 의한 안정성 문제가 있었습니다
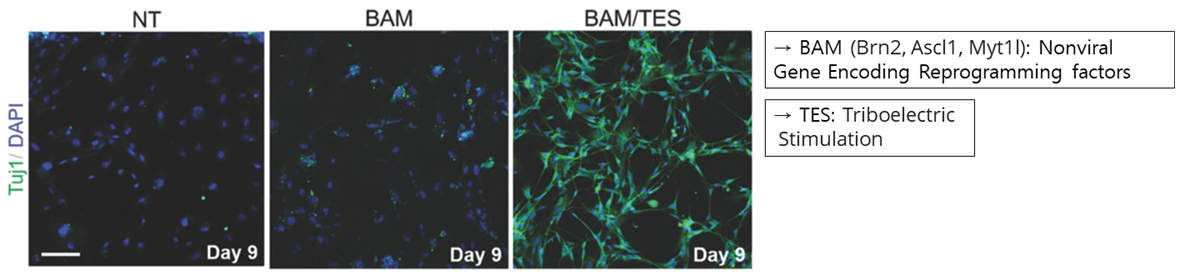
따라서 Nonviral Gene Delivery를 이용한 연구들이 진행되었는데요. 하지만 Nonviral Gene Delivery만을 통한 신경 세포 회복은 위의 그림에서도 볼 수 있듯이 효율이 매우 낮았습니다. 이에 조 연구팀은, 오른쪽 그림과 같이 Nonviral Gene Delivery 이후의 Triboelectric Stimulation이fiboblast가 신경 세포로 분화되는 것을 가속화하여 신경세포의 회복을 도울 수 있다는 것을 발견하였고, 이는 치매와 같은 퇴행성 신경질환과 같은 병을 치료하는데 응용될 수 있겠습니다
> Bioresorbable E-Drug
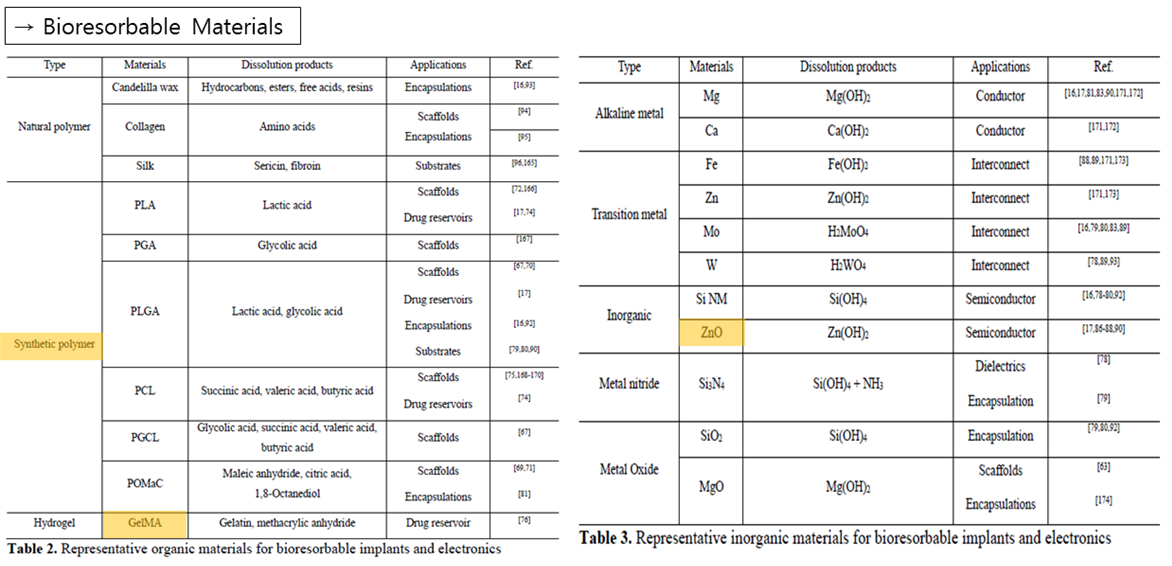
다음으로는 생채 내에서 분해될 수 있는 Bioresorbable E-drug에 대해 살펴보겠습니다. Bioresorbable한 특성은, E-drug가 우리 몸에 직접 들어가게 되므로 굉장히 중요한 부분인데요. 이에 앞서 먼저, 대표적인 Bioresorbable Material들을 살펴보겠습니다. 폴리에스테르의 경우 PLA, PGA, PLGA 등 Synthetic Biomaterial에 사용되는 대표적인 Bioresorbable Material입니다. 이는 폴리에스테르가 에스테르 결합으로 이루어져있어 가수분해에 의해 용해될 수 있기 때문입니다. 따라서 폴리에스테르를 이용한 Synthetic Polymer의 Base Material의 경우, 그 비율을 변화시킴으로써 분해되는 시간을 조절할 수도 있습니다. 다음으로는 GelMA입니다. GelMA란 Gelatin으로 구성된 Hydrogel Polymer로 세포에 맞는 최적의 조건을 제공하며, UV에 의해 쉽게Corss Linking되는 형태에 대한 안정성을 보여줍니다. 또한, ‘Cell adhesion’, ‘Biocompability’, ‘Biodegradibility’와 같은 특성을 가진 GelMA는 혈관, 연골. 뼈성장을 위한 3D Scaffolding로 응용되며, 3D Printing에서 Bio-ink로도 이용됩니다. 또한 전에 Piezoelectric patch에서 사용된 ZnO의 경우도 Boresorbable한 특성을 지닌 Semiconductor중 하나로, Energy generator나 Memory device 등을 제작하는데도 사용됩니다
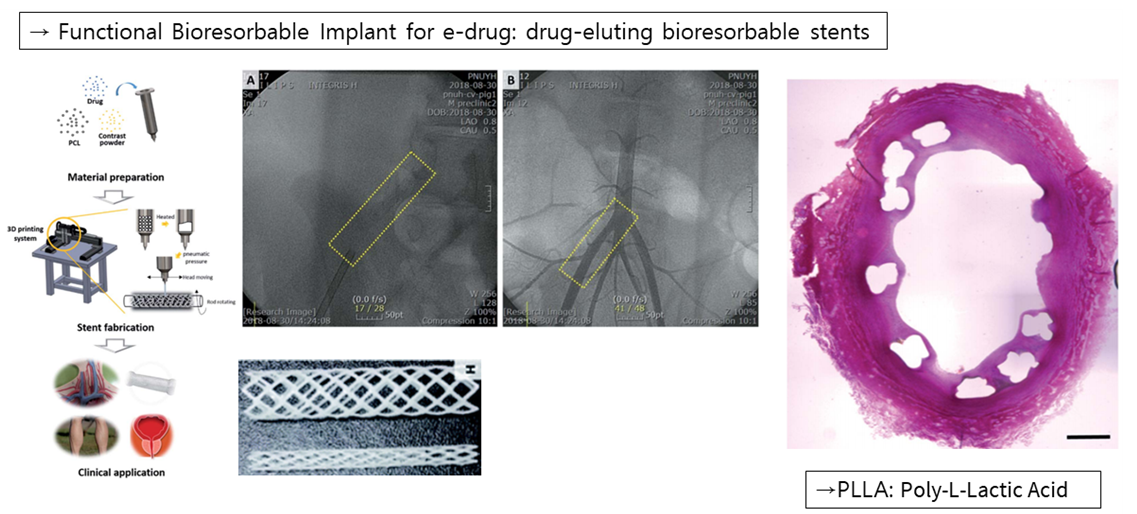
다음으로는 이러한 Bioresorbable material을 사용한 Implant E-drug들에 대해 살펴보겠습니다. 기존의 Stent의 경우 대부분 메탈로 만들어지는데 이는 종종 면역반응을 일으켜 다시 재협착층을 유래하기도 합니다. 따라서 조 연구팀은 ‘PLLA’라는 Bioresorbable 소재를 사용한 약물 방출형 Stent를 개발하여 기존의 문제점들을 해결하고자 했습니다. 오른쪽 그림의 경우 bioresorbable stent에 의해 재협착증 없이 혈관이 잘 확장된 모습입니다
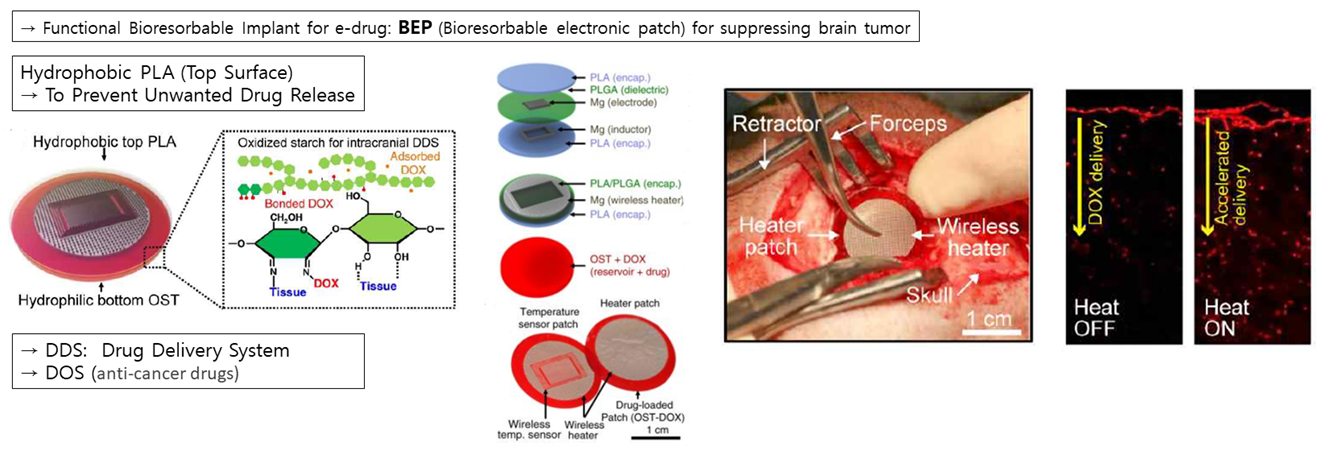
다음으로 김 연구팀은 Bioresorbable Electronic Patch를 통해 뇌종양을 억제할 수 있는 연구를 진행하였습니다. 기존의 정맥 주사치료법은 혈뇌장벽에 의해 그 효과가 감소될 때가 많았습니다. 따라서 직접 뇌에 패치를 붙여 그 효과를 높이려는 실험을 진행하였는데요. 이는 산화된 녹말에 붙은 독소루부신을 Target area에서 방출시켜 뇌종양을 억제하는 원리이며, Mg기반의 무선 Heater를 통해 약물의 효과를 최대화 시켰습니다
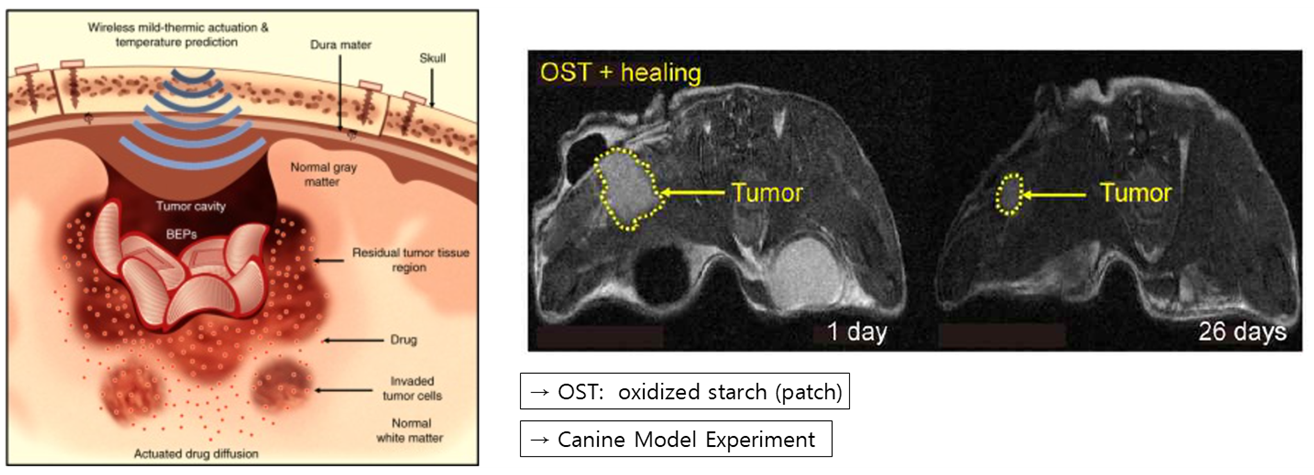
그 결과 오른쪽 그림과 같이 뇌종양의 크기가 확연히 줄어든 것을 확인할 수 있었으며, Bioresorbable Electronic Patch가 직접적으로 뇌종양을 억제하는데 효과가 있는 것을 확인할 수 있습니다
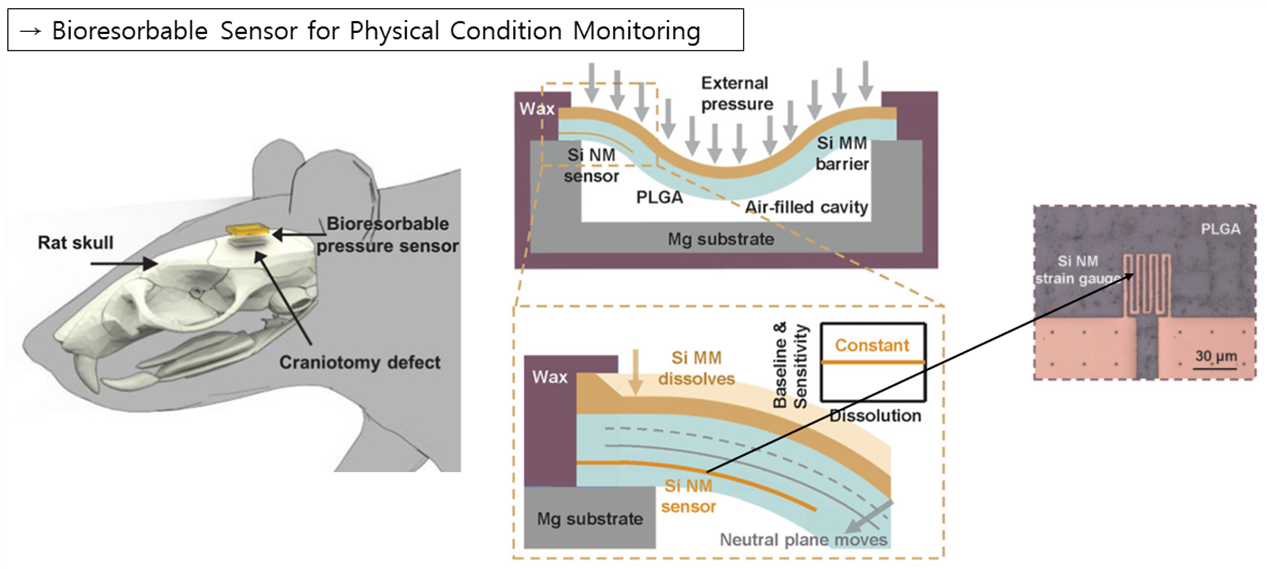
다음으로는 Bioresorbable Sensor에 대해 살펴보겠습니다. A. Rogers 연구팀은 두개골 공간 내에서의 피에조 저항값을 통한 Bioresorbable 압력 센서를 개발하였습니다. 위의 실리콘 층은 Biofluid로 부터 센서를 보호하는 역할을 하며, 외부와 Cavity안 공기 사이에 압력 차이에 의해 구부러진 정도에 따라 Nanomembrane의 Si-피에조 저항값을 얻을 수 있었습니다
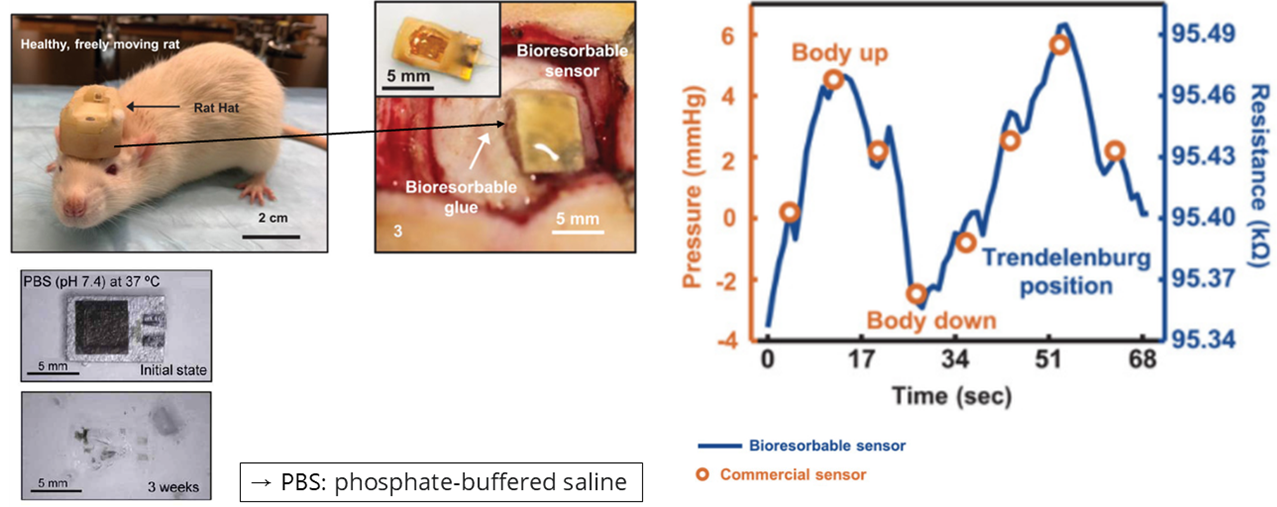
이를 상업적으로 사용되는 압력센서와 비교하여 그 성능을 비교해볼 때, 거의 유사한 성능을 확인할 수 있었으며 Bioresorbable한 특성 또한 왼쪽 아래의 실험을 통해 확인할 수 있었습니다
> Long-Term Implantable E-Drug
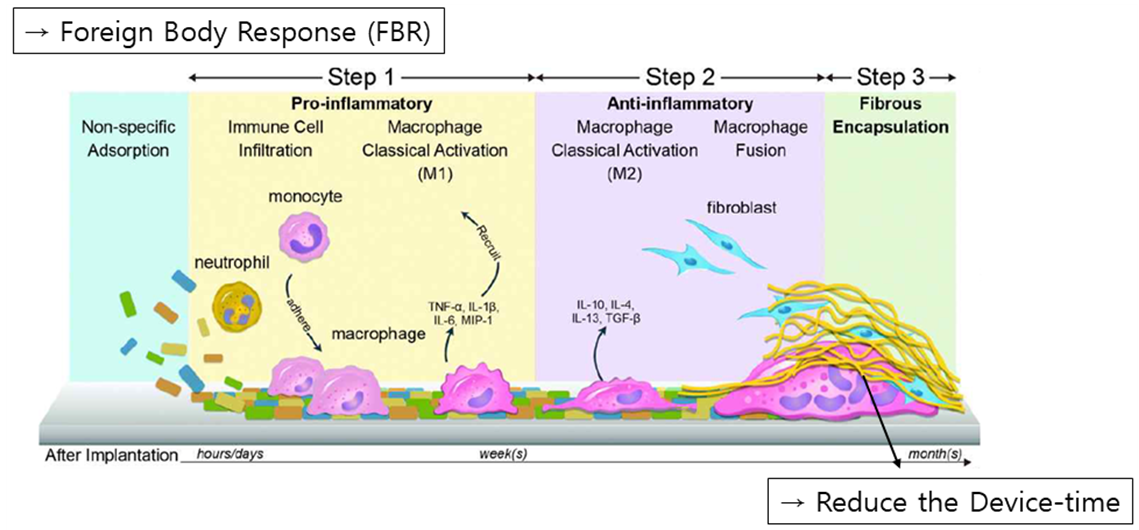
다음으로는 장기간의 Implantable E-drug에 대한 연구들을 살펴보겠습니다. 그 전에 장기간의 임플란트에서 가장 큰 문제점인 Foreign Body Response에 대해 먼저 소개해드리겠습니다. Foreign Body Response란 우리 몸에서 외부 물질에 대해 나타나게 되는 면역반응으로, 시간이 경과하면서 임플란트 표면에 단백질과 면역세포 등이 달라 붙어 만들어진 Fibrous 캡슐이 임플란트를 감싸게 되어 결국 그 기능을 손상시키게 됩니다. 따라서 연구자들은 계속해서 FBR을 최소화시킬 수 있는 방법들을 연구해왔는데요
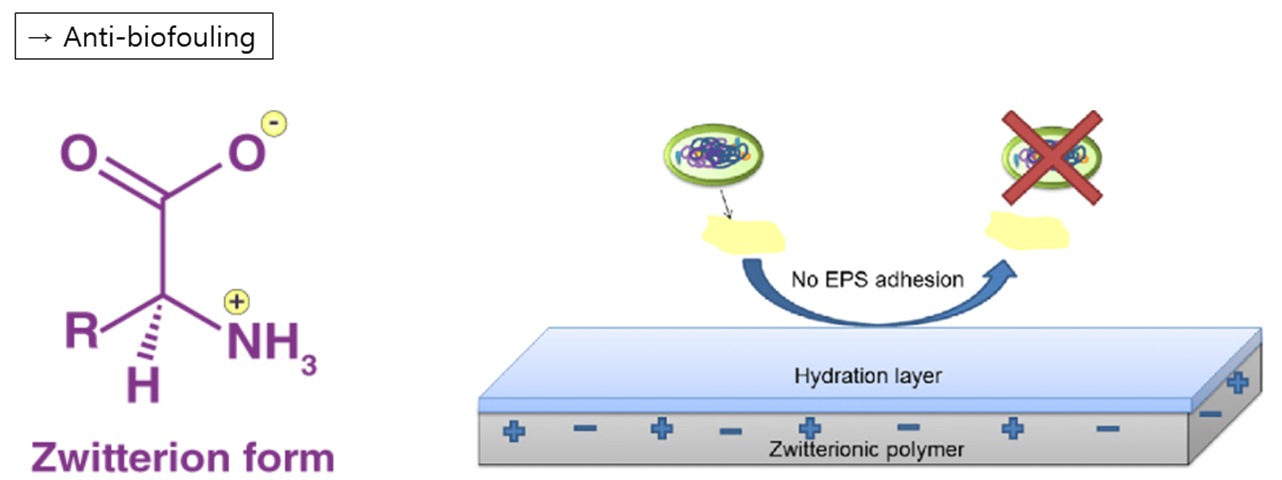
첫 번째 방법은 표면을 Anti-biofouling하게 만들어 면역세포 및 단백질들이 달라붙지 못하게 하는 방법입니다. 이러한 표면을 만들기 위해 여러 연구들이 진행되어 왔는데요. 최근 소수성 표면의 한계를 뛰어넘는 Zwitterionic Polymers(쌍성이론 고분자)를 이용한 Surface연구가 활발하게 진행되어 왔습니다. Zwitterionic Polymers란 분자 체인에 음이온 그룹과 양이온 그룹을 모두 갖는 고분자로, Zwitterionic 이온 쌍들이 주변의 물분자들과 정전기적 상호작용으로 강하게 결합되면서 표면에 Water Barrier를 형성하여 Anti-biofouling한 특성을 갖게 됩니다
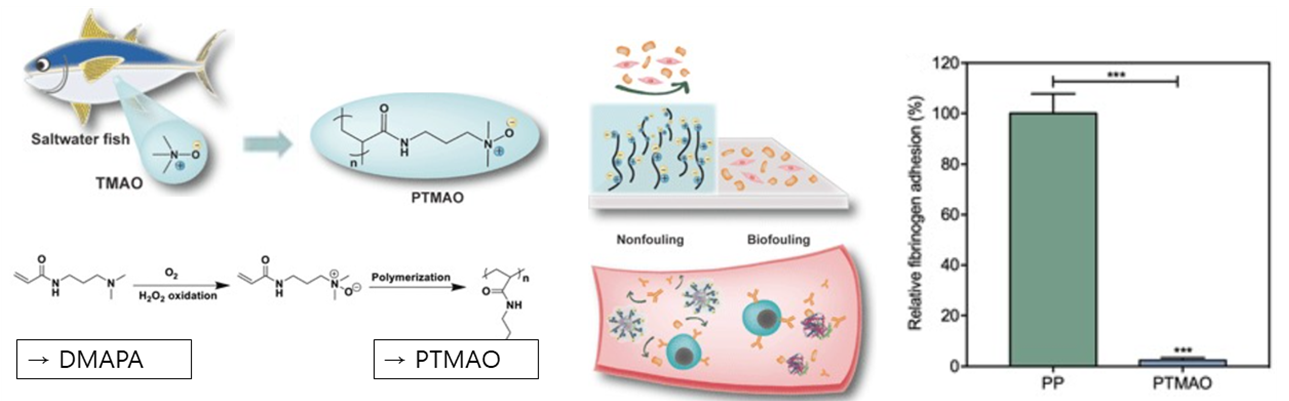
S. Jiang 연구팀은 생선 껍질에서 TMAO라는 삼투제를 응용한 PTMAO라는 Zwitterionic Polymer를 개발하였습니다. 이를 오른쪽 그래프와 같이 폴리에프릴렌과 비교하여 혈장을 구성하는 단백질인 Fibrinogen이 부착되는 정도를 확인해본 결과, 친수성에 가까운 폴리에프필렌에는 많은 양의 피브리노겐 단백질이 달라붙은 반면, PTMAO 표면에는 피브리노겐이 거의 달라붙지 않은 것을 확인할 수 있으며 이를 통해 다시 한 번 Zwitterionic Polymer Coating의 Antibiofouling한 기능을 확인할 수 있었습니다
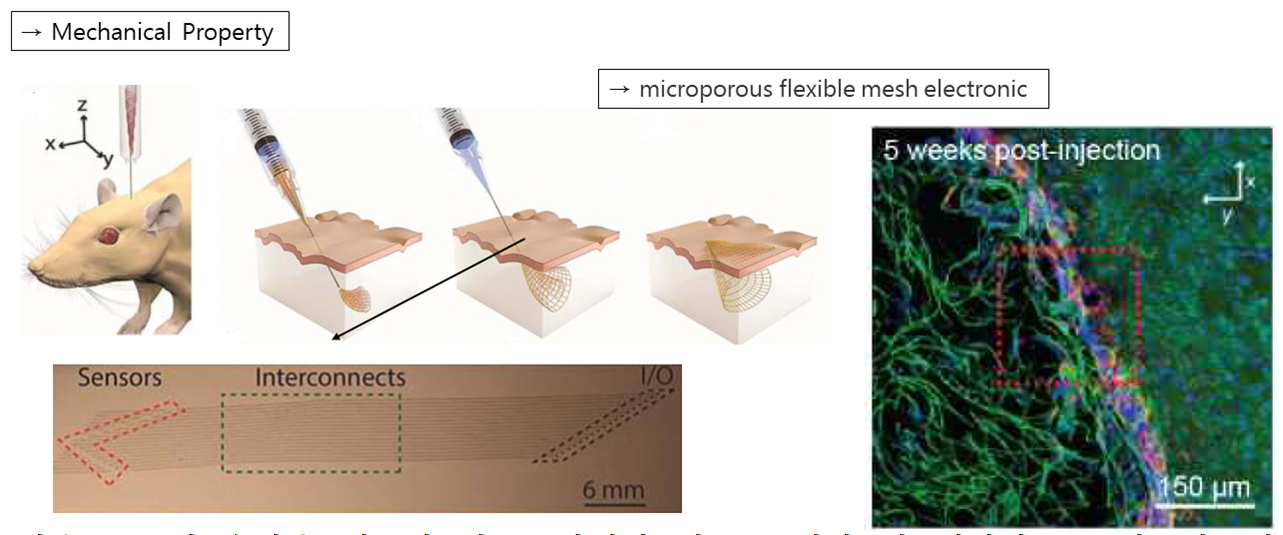
다음은 조직 손상을 최소화 하고, 타켓이 되는 조직과 잘 매치되도록 임플란트의 Mechanical Property를 바꾸어 FBR을 최소화하는 연구에 대해 소개해드리겠습니다. C. M. Lieber 연구팀은 Microporous의 Flexible Mesh Electronic를 통해 신경 세포들을 관찰하고, 신호들을 읽어드릴 수 있는 센서를 개발하였습니다. 주사를 통해 직접 주입된 Flexible Mesh한 구조는 표면 조직과 잘 Interconnect되어 기존의 임플란트에 비해 조직 손상을 줄여 FBR을 방지할 수 있었습니다
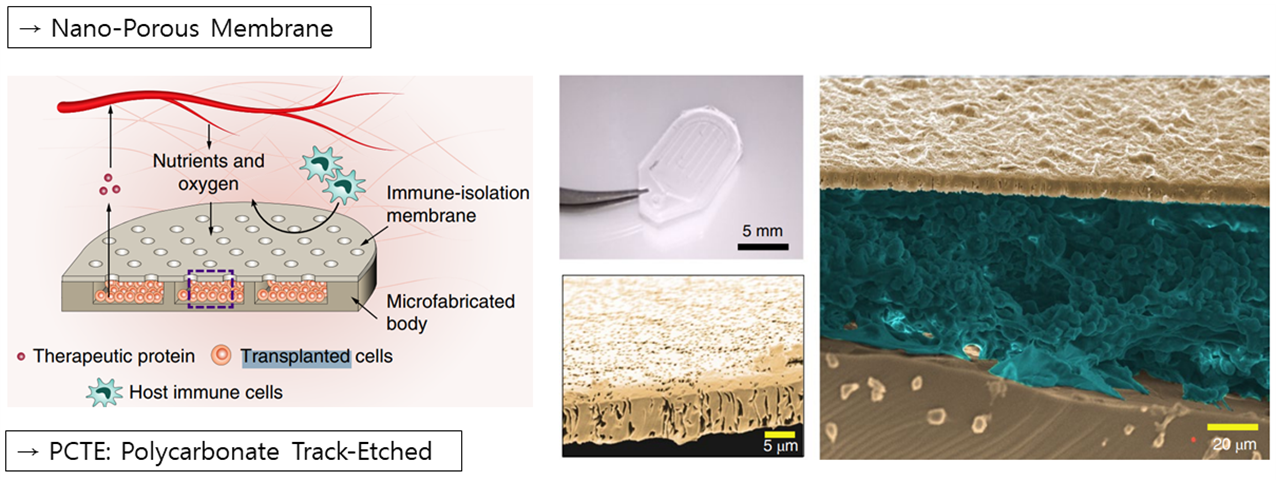
세 번째 방법으로는 Nano-Porous Membrane을 응용한 캡슐을 통해 FBR을 방지하는 연구에 대해 소개해드리겠습니다. FBR이 장기간의 임플란트에서 성능을 저하시키는 이유는 임플란트 표면 위에 캡슐처럼 쌓여진 대식세포나 염증 세포들이 Drug- releasing를 막아버리고, 그 위의 산소나 포도당과 같은 영양분을 먹어 남기게 되는 부산물들이 기기와 반응을 일으켜 손상시키기 때문입니다
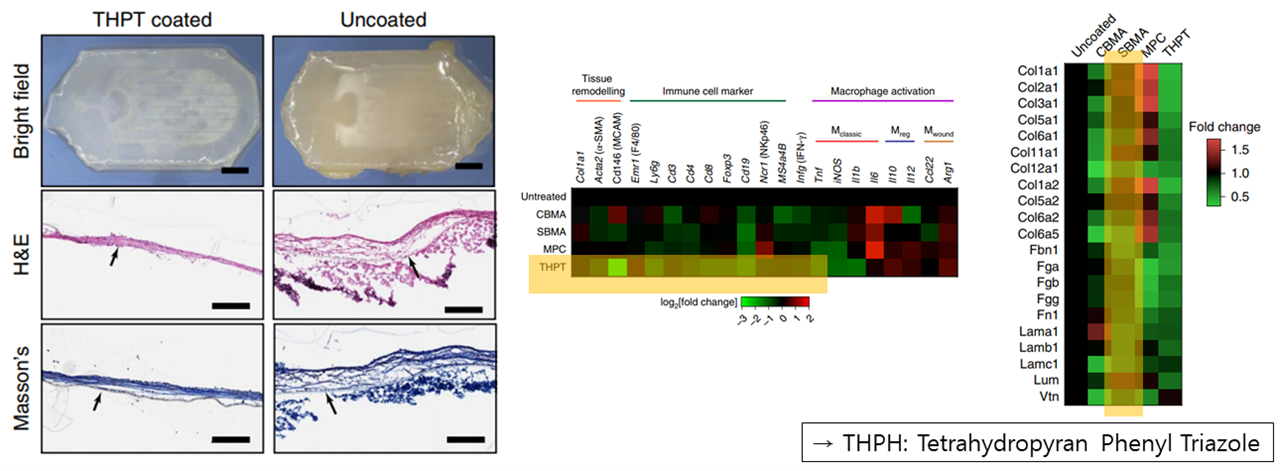
따라서 D. G. Anderson 연구팀은 PCTE라는 생체적용가능한 Nano-Porous Membrane을 통해 위와 같은 문제를 해결할 수 있는 연구를 진행하였습니다. PCTE의 경우 Pore의 사이즈가 0.8um 보다 살짝 작은 정도로, 이는 면역세포가 캡슐안으로 들어가는 것은 막으면서 Drug releasing과 Oxygen, Glucose와 같은 영양분은 통과시킬 수 있게 하는 크기입니다. 또한, 그 위에 Fibrosis의 형성을 막는 THPT코팅을 해줌으로써 FBR에 의한 캡슐 손상을 최소화할 수 있었습니다. 왼쪽의 그림에서 볼 수 있듯이 THPT 코팅을 한 쪽에서 훨씬 적은 Fibrosis 층이 관측되었으며, 가운데와 오른쪽 그래프를 통해 면역세포를 만드는 Particle이나 Fibrosis층의 형성을 도와주는 콜라겐 단백질들에 대한 부착을 상당 부분 방지하였다는 것 또한 확인할 수 있었습니다
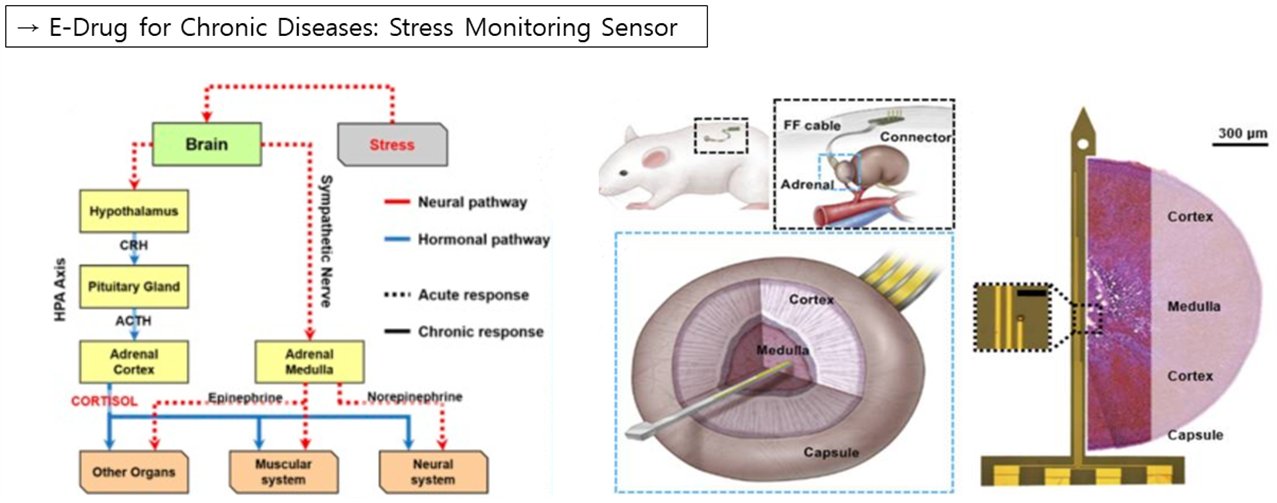
마지막으로 만병의 근원인 Stress를 onitoring하기 위한 센서에 대한 소개를 하겠습니다. 사람이 스트레스를 받게 되면 신경계와 호르몬계에서 각각 반응이 나타나게 됩니다. 먼저 신경이 부신 중앙에 있는 Medulla에 전달되게 되면 Medulla는 아드레날린을 분비하여 잠시동안 우리 몸의 교감신경이 흥분되도록 합니다. 그동안 사상하부에서는 콜티코트로핀 방출을 조절하는 호르몬을 뇌하수체에 전달하며, 이에 뇌하수체는 부신 피질 자극 호르몬을 방출하고 이 호르몬이 부신의 피질부분에 도달하면서 콜티졸을 형성하게 되어 흥분되어 있던 교감신경 및 근육기관들을 조절되게 됩니다. 따라서 김 연구팀은 부신의 겉질과 Medulla를 관통하는 Sensor를 통해 스트레스를 Monitoring하는 Stress Monitoring Sensor를 개발하였습니다
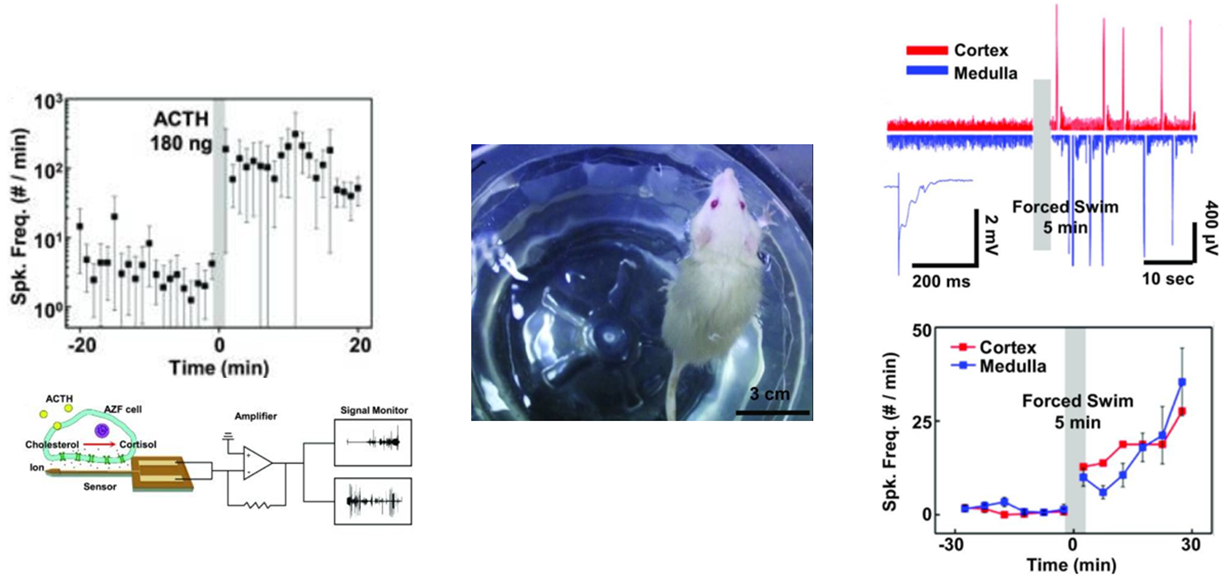
신호를 얻는 원리는 왼쪽 아래 그림과 같이, 뇌하수체에서 부신 피질 자극 호르몬이 분비되어 피질 다발층의 수용기와 결합하게 되면 세포막 사이로 이온 교환이 발생하게 되는데 센서는 이러한 이온의 포텐셜 변화를 감지하여 센싱을 하게 됩니다. 왼쪽 위의 그래프에서 알 수 있듯이 부신 피질 자극 호르몬을 주입한 이후 Spike frequency가 증가한 것을 확인할 수 있으며, 오른쪽과 같이 쥐가 스트레스를 받도록 강제로 수영을 시킨 상황에서도 피질과 미들라에서 Spike frequency가 관측되었음을 통해 센서가 잘 작동하는 것을 확인할 수 있습니다
<Conclusion>
지금까지 기존의 치료법들과 그에 대한 한계점, 그리고 최근 활발하게 연구되고 있는 E-drug연구들에 대해 자세히 살펴보았습니다. E-drug를 통해 몸에서의 중요한 신호들을 더욱 잘 얻을 수 있게 되었고, 환자의 부담을 덜어줄 수 있었으며, 시간-경제적으로도 더욱 효율적인 치료 및 진단이 가능했습니다. 하지만 안전성과 생물-적합성, FBR등의 해결해야할 문제들이 여전히 남아있지만 지속적인 연구들이 진행된다면 더욱 좋은 응용 및 결과가 있을 것이라고 예상됩니다.
